Năng lượng của Electron vô nguyên vẹn tử :
+) Mức tích điện obitan nguyên vẹn tử : 
Bạn đang xem: mỗi obitan nguyên tử chứa tối đa
Trong nguyên vẹn tử, những electron bên trên từng obitan với cùng một nấc tích điện xác lập. Người tao gọi nấc tích điện này là nấc tích điện obitan nguyên vẹn tử (mức tích điện AO)
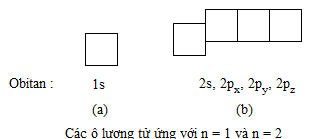
Các electron bên trên những obitan không giống nhau của và một phân lớp với tích điện như nhau. Thí dụ : Ứng với n=2, tao với 2 phân lớp là 2s và 2p. Phân lớp 2s chỉ tồn tại một obitan 2s, còn phân lớp 2p với 3 obitan : 2px,2py,2pz. Các electron của những obitan p vô phân lớp này tuy rằng với sự triết lý vô không khí không giống nhau, tuy nhiên bọn chúng với nằm trong nấc tích điện AO.
+) Trật tự động những nấc tích điện obitan nguyên vẹn tử
Thực nghiệm và lí thuyết đã cho thấy Lúc số hiệu nguyên vẹn tử Z tăng, những nấc tích điện AO tăng dần dần bám theo trình tự động sau :
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d....
Từ trình tự động nấc tích điện AO bên trên đã cho thấy Lúc năng lượng điện phân tử nhân tăng với sự chèn nấc tích điện, nấc 4s trở thành thấp rộng lớn 3d, nấc 5s thấp rộng lớn 4d,6s thấp rộng lớn 4f,5d,...
+) Các nguyên vẹn lí và quy tắc phân bổ Electron vô nguyên vẹn tử
Sự phân bổ những electron vô nguyên vẹn tử tuân bám theo nguyên vẹn lí Pau-li, nguyên vẹn lí vững chắc và quy tắc Hun (F.Hund).
+) Nguyên lí Pau-li :
- Ô lượng tử
Để trình diễn obitan nguyên vẹn tử một cơ hội giản dị và đơn giản, người tao còn sử dụng dù vuông nhỏ, được gọi là dù lượng tử. Một dù lượng tử ứng với cùng một AO. Thí dụ : Ứng với n=1 chỉ tồn tại một onitan 1s, tao vẽ một dù vuông. Ứng với n=2 với cùng một obitan 2s và tía obitan 2p(2px,2py,2pz), tao vẽ một dù vuông nằm trong phân lớp 2s và tía dù vuông này được vẽ ngay tắp lự nhau, nhằm chỉ rằng những obitan 2p với nằm trong nấc tích điện AO, tuy nhiên cao hơn nữa AO−2s như hình vẽ sau :
- Nguyên lí Pau-li
Trên một obitan chỉ rất có thể có không ít nhất là nhì electron và nhì electron này vận động tự động con quay không giống chiều nhau xung xung quanh trục riêng rẽ của từng electron. Người tao biểu thị chiều tự động con quay không giống nhau xung quanh trục riêng rẽ của nhì electron vì thế 2 mũi thương hiệu nhỏ : Một mũi thương hiệu với chiều tăng trưởng, một mũi thương hiệu với chiều trở lại. Trong một obitan đang được với 2 electron, thì 2 electron tê liệt gọi là electron ghép song. Khi obitan chỉ tồn tại một electron thì electron tê liệt gọi là electron đơn thân.

- Số electron tối nhiều vô một tờ và vô một phân lớp
. Số electron tối nhiều vô một tờ electron : Ta đang được biết lớp n2 obitan. Mỗi obitan bám theo nguyên vẹn lí Pau-li với tối nhiều 2 electron. Do tê liệt : Lớp n với tối nhiều 2 n2 electron.
. Số electron tối nhiều vô một phân lớp electron. Cũng bám theo nguyên vẹn lí Pau-li, tao rất có thể hiểu rằng số electron tối nhiều vô một phân lớp. Phân lớp s chỉ tồn tại một obitan, vậy chỉ mất tối nhiều 2 electron. Phân lớp p với 3 obitan nên với tối nhiều 6 electron, tương tự động phân lớp d với tối nhiều 10 electron, phân lớp f với tối nhiều 14 electron. Ta rất có thể trình diễn số electron tối nhiều trong những phân lớp vì thế những dù lượng tử như hình vẽ dưới

Một cách tiếp theo, nhằm trình diễn hiện trạng electron của obitan 1s chứa chấp 2 electron tao sử dụng kí hiệu : 1s2. Tại phía trên, số 1 đứng phía bên trái chỉ lớp n=1, chữ s chỉ obitan s, số 2 ở phía bên trên ở bên phải chỉ số electron với chứa chấp vô obitan 1s. Giả sử phân lớp 2p với 6 electron, tao ghi chép : 2p6.
Các phân lớp : s2,p6,d10,f14 với đầy đủ số electron tối nhiều gọi là phân lớp bão hoà. Còn phân lớp ko đầy đủ số electron tối nhiều gọi phân lớp ko bão hoà. Thí dụ những phân lớp s1 , p3,d7,f12....
+) Nguyên lí vững chắc :
Ở hiện trạng cơ phiên bản, vô nguyên vẹn tử những electron rung rinh theo thứ tự những obitan với nấc tích điện kể từ thấp cho tới cao.
Thí dụ :
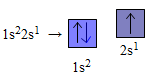
Nguyên tử hiđro (Z=1) có một electron, electron này tiếp tục rung rinh obitan 1s(AO−1s) với nấc tích điện thấp. Do tê liệt rất có thể trình diễn sự phân bổ electron của nguyên vẹn tử hiđro là 1s1; Biểu trình diễn vì thế dù lượng tử là : 
Xem thêm: các biện pháp bảo vệ môi trường
Nguyên tử heli (Z=2) với 2 electron. Theo nguyên vẹn lí Pau-li, nhì electron này nằm trong rung rinh obitan 1s với nấc tích điện thấp nhất. Bởi vậy sự phân bổ electron bên trên obitan của heli là 1s2→ 
Nguyên tử liti (Z=3) với 3 electron, 2 electron trước rung rinh obitan 1s và đang được bão hoà, electron còn sót lại rung rinh obitan 2s tiếp theo sau với nấc tích điện cao hơn nữa. Do tê liệt sự phân bổ electron bên trên những obitan của liti là :
Một cơ hội tương tự động, tao rất có thể ghi chép được sự phân bổ electron bên trên những obitan của những thành phần tiếp theo sau.
Thí dụ :

Tuy nhiên, ko nhất thiết khi nào thì cũng nên trình diễn những AO−2p nên cao hơn nữa AO−2s,... vì thế tiếp tục kềnh càng. Người tao chỉ trình diễn sự cao, thấp của những dù lượng tử Lúc cần thiết thể hiện nay nấc tích điện không giống nhau của từng phân lớp electron.
+) Quy tắc Hun
Trong và một phân lớp, những electron tiếp tục phân bổ bên trên những obitan sao mang đến số electron đơn thân là tối nhiều và những electron này nên với chiều tự động con quay như là nhau.
Thí dụ sự phân bổ electron bên trên những obitan của nguyên vẹn tử cacbon, nitơ như sau :

Các electron đơn thân vô một nguyên vẹn tử được kí hiệu vì thế những mũi thương hiệu nằm trong chiều, thông thường được ghi chép phía lên bên trên.
Cấu hình Electron nguyên vẹn tử :
+) Cấu hình electron nguyên vẹn tử
Xem thêm: giải pháp bảo vệ môi trường
Cấu hình electron nguyên vẹn tử trình diễn sự phân bổ electron bên trên những phân lớp với mọi lớp không giống nhau.
Quy ước cơ hội ghi chép thông số kỹ thuật electron nguyên vẹn tử :
- Số trật tự lớp electron được ghi chép vì thế những chữ số (1,2,3...)
- Phân lớp được kí hiệu vì thế vần âm thông thường (s,p,d,f)
- Số electron được ghi vì thế chỉ số ở phía bên trên, ở bên phải kí hiệu của phân lớp (s2 , p2,...)
Cách ghi chép thông số kỹ thuật electron nguyên vẹn tử :
- Xác toan số electron của nguyên vẹn tử.
- Các electron được phân bổ bám theo trật tự tăng dần dần những nấc tích điện AO, bám theo những nguyên vẹn lí và quy tăc phân bổ electron vô nguyên vẹn tử.
- Viết thông số kỹ thuật electron bám theo trật tự những phân lớp bên trong một tờ và bám theo trật tự của những lớp electron
Thì dụ :
Na (Z = 11) với 11 electron. Cấu hình electron của Na như sau : 1s22s22p63s1
Fe (Z = 26) với 26 electron. Do với sự chèn nấc tích điện, những electron được phân bổ như sau : 1s22s22p63s23p64s23d6
Sau tê liệt nên bố trí những phân lớp bám theo từng lớp : 1s22s22p63s23p63d64s2
Hoặc ghi chép gọn gàng là : [Ar]3d64s2
[Ar] là kí hiệu thông số kỹ thuật electron nguyên vẹn tử của thành phần agon, là khí khan hiếm sớm nhất đứng trước Fe.
+) Cấu hình electron nguyên vẹn tử của một vài thành phần :
Dựa vô những nguyên vẹn lí và quy tắc nêu phía trên tao rất có thể xây cất thông số kỹ thuật electron nguyên vẹn tử của những thành phần không giống. Dưới đó là thông số kỹ thuật electron nguyên vẹn tử của trăng tròn thành phần thứ nhất vô bảng tuần trả.
+) Đặc điểm của lớp electron ngoài cùng
Các electron ở lớp bên ngoài nằm trong ra quyết định đặc điểm hoá học tập của một thành phần.
- Đối với nguyên vẹn tử của những thành phần, số electron lớp bên ngoài nằm trong tối nhiều là 8. Các nguyên vẹn tử với 8 electron lớp bên ngoài nằm trong thường rất bền vững và kiên cố, bọn chúng hầu hết ko nhập cuộc vô những phản xạ hoá học tập. Đó là những nguyên vẹn tử khí khan hiếm ( trừ He với số electron lớp bên ngoài nằm trong là 2)
- Các nguyên vẹn tử có một,2,3 electron ở lớp bên ngoài nằm trong là những nguyên vẹn tử sắt kẽm kim loại ( trừ H, He và B)
- Các nguyên vẹn tử với 5,6,7 electron ở lớp bên ngoài nằm trong là những nguyên vẹn tử phi kim.
- Các nguyên vẹn tử với 4 electron ớ lớp bên ngoài nằm trong rất có thể là nguyên vẹn tử sắt kẽm kim loại hoặc phi kim.













Bình luận