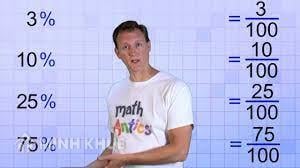
Chủ đề Công thức tính bộ phận Xác Suất khối lượng: Công thức tính bộ phận Xác Suất lượng là 1 dụng cụ cần thiết nhập chất hóa học hùn tất cả chúng ta hiểu rằng tỉ trọng Xác Suất của những nhân tố nhập một phù hợp hóa học. phẳng phương pháp tính toán giản dị và đơn giản dựa vào lượng của nhân tố và lượng của phù hợp hóa học, tớ rất có thể thám thính làm rõ rộng lớn về bộ phận cấu trúc của hóa học và vận dụng trong vô số nghành nghề như phân tách chất hóa học, phân tích khoa học tập và phát triển công nghiệp.
Cách tính Xác Suất lượng của bộ phận nhập láo lếu phù hợp là gì?
Cách tính Xác Suất lượng của bộ phận nhập láo lếu phù hợp như sau:
1. Xác toan lượng của bộ phận cơ nhập láo lếu phù hợp. Vấn đề này rất có thể được triển khai bằng phương pháp bằng vận lượng của bộ phận cơ.
2. Xác toan tổng lượng của toàn cỗ láo lếu phù hợp.
3. Sử dụng công thức: Xác Suất lượng = (khối lượng của trở thành phần/khối lượng của toàn cỗ láo lếu hợp) x 100% nhằm đo lường và tính toán Xác Suất lượng của bộ phận cơ nhập láo lếu phù hợp.
Ví dụ: Giả sử tất cả chúng ta với 1 láo lếu phù hợp bao gồm 80g muối hạt (NaCl) và 120g nước (H2O). Để tính Xác Suất lượng của muối hạt nhập láo lếu phù hợp này, tớ triển khai công việc sau:
1. Xác toan lượng của muối hạt là 80g.
2. Tổng lượng của láo lếu phù hợp là 80g (muối) + 120g (nước) = 200g.
3. sát dụng công thức: Xác Suất lượng của muối hạt = (80g/200g) x 100% = 40%.
Vì vậy, Xác Suất lượng của muối hạt nhập láo lếu phù hợp này là 40%.
Bạn đang xem: cách tính phần trăm khối lượng

Công thức tính Xác Suất lượng là gì?
Công thức tính Xác Suất lượng là (khối lượng chất/khối lượng láo lếu hợp) x 100%. Để tính Xác Suất lượng của một hóa học nhập láo lếu phù hợp, tất cả chúng ta nên biết lượng của hóa học cơ và lượng của toàn cỗ láo lếu phù hợp. Sau cơ, lấy lượng của hóa học phân tách mang đến lượng láo lếu phù hợp và nhân thành quả với 100%, tất cả chúng ta sẽ sở hữu được Xác Suất lượng của hóa học cơ nhập láo lếu phù hợp.
Giải quí rõ ràng về lượng mol nhân tố và lượng phân tử của phù hợp chất?
Khối lượng mol nhân tố (M) là lượng của một mol nhân tố, được xem vị đơn vị chức năng gram. Mol là 1 đơn vị chức năng đo lường và tính toán nhập chất hóa học, ứng với số Avogadro (6.02 x 10^23) những đơn vị chức năng hiệu rõ ràng của một hóa học. Ví dụ, lượng mol của nhân tố sắt kẽm kim loại như Fe (Fe) là 55.85 gram/mol, Tức là một mol Fe với lượng là 55.85 gram.
Khối lượng phân tử của phù hợp hóa học cũng khá được tính vị đơn vị chức năng gram. Nó được khái niệm là tổng lượng của toàn bộ những nguyên vẹn tử nhập một phân tử của phù hợp hóa học cơ. Ví dụ, lượng phân tử của nước (H2O) là 18 gram/mol, cũng chính vì một phân tử nước chứa chấp nhì nguyên vẹn tử hydro (H) với lượng mol là 1 trong những gram/mol và một nguyên vẹn tử oxy (O) với lượng mol là 16 gram/mol.
Khi đo lường và tính toán Xác Suất lượng của một phù hợp hóa học, tất cả chúng ta dùng công thức sau: Xác Suất lượng = (khối lượng mol nguyên vẹn tố/khối lượng phân tử của phù hợp chất) x 100. Công thức này hùn tất cả chúng ta xác lập tỷ trọng lượng của từng nhân tố nhập phù hợp hóa học.
Ví dụ, nhằm tính Xác Suất lượng của nước nhập một láo lếu phù hợp chứa chấp 100 gram nước và 50 gram muối hạt (NaCl), tất cả chúng ta cần thiết đo lường và tính toán lượng mol của từng nhân tố và lượng phân tử của tất cả nhì phù hợp hóa học. Sau cơ, tất cả chúng ta vận dụng công thức Xác Suất lượng nhằm đo lường và tính toán tỷ trọng Xác Suất lượng của nước nhập láo lếu phù hợp.
Hy vọng vấn đề này khiến cho bạn làm rõ rộng lớn về lượng mol nhân tố và lượng phân tử của phù hợp hóa học.

Tính Xác Suất lượng những nhân tố và tỉ trọng lượng những nhân tố - Hóa học tập trung học cơ sở 89
Bạn đang được khi nào tò mò mẫm về nguyên vẹn tử và nhân tố là gì không? Video này tiếp tục cung ứng cho chính mình một chiếc coi sâu sắc rộng lớn về nguyên vẹn tử và nhân tố, na ná phương pháp tính toán tỉ trọng lượng trong những phù hợp Hóa chất. Đừng bỏ qua nó!
Tại sao cần thiết tính Xác Suất lượng Khi phân tách phù hợp chất?
Phần trăm lượng được xem Khi phân tách phù hợp hóa học nhằm mục tiêu xác lập tỉ trọng Xác Suất của từng bộ phận nhập phù hợp hóa học cơ theo đòi lượng. Việc này vô cùng cần thiết nhập phân tích và phân tách chất hóa học. Dựa nhập Xác Suất lượng, tớ rất có thể thám thính hiểu rõ sự hiện hữu và góp sức của từng bộ phận nhập phù hợp hóa học, kể từ cơ rất có thể thể hiện những phán xét và Tóm lại về đặc thù và phần mềm của phù hợp hóa học cơ.
Để tính Xác Suất lượng của từng bộ phận nhập phù hợp hóa học, tớ nên biết lượng của từng bộ phận cơ và tổng lượng của toàn bộ những bộ phận nhập phù hợp hóa học. Công thức tính Xác Suất lượng là:
Phần trăm lượng = (khối lượng trở thành phần/khối lượng phù hợp chất) x 100%
Trong công thức bên trên, lượng bộ phận là lượng của từng bộ phận nhập phù hợp hóa học cần thiết tính Xác Suất lượng. Khối lượng phù hợp hóa học là tổng lượng của toàn bộ những bộ phận nhập phù hợp hóa học.
Việc tính Xác Suất lượng rất có thể hùn tất cả chúng ta thâu tóm được tỉ trọng Xác Suất của từng bộ phận nhập một phù hợp hóa học phức tạp, kể từ cơ rất có thể thể hiện những phần mềm và vận dụng trong những nghành nghề như hóa dược, hóa sinh, quy trình phát triển và đánh giá unique.
Có những bước này nhằm tính Xác Suất khối lượng?
Để tính Xác Suất lượng của một hóa học nhập một láo lếu phù hợp, tớ rất có thể tuân theo đòi công việc sau:
1. Tính lượng của hóa học cần thiết tính Xác Suất lượng, gọi là M.
2. Tính lượng của toàn cỗ láo lếu phù hợp hoặc hóa học cần thiết tính Xác Suất lượng nhập đơn vị chức năng lượng, gọi là W.
3. sát dụng công thức: Phần trăm lượng = (M/W) x 100%.
Ví dụ, nhằm tính Xác Suất lượng của một hóa học A nhập một láo lếu phù hợp, tớ tiếp tục triển khai công việc sau:
1. Đo lường lượng của hóa học A, gọi là M.
2. Đo lường lượng toàn cỗ láo lếu phù hợp, gọi là W.
3. sát dụng công thức: Phần trăm lượng của hóa học A = (M/W) x 100%.
Ví dụ bên trên chỉ là 1 tình huống cơ phiên bản, nhập thực tiễn rất có thể có rất nhiều hóa học được trộn lẫn lại cùng nhau. Trong tình huống cơ, tớ cần thiết tính lượng của từng hóa học riêng lẻ và tổng lượng của toàn bộ những hóa học nhập láo lếu phù hợp.
Thông qua chuyện công việc bên trên, tớ rất có thể đơn giản và dễ dàng đo lường và tính toán và xác lập Xác Suất lượng của những hóa học nhập láo lếu phù hợp.
Xem thêm: ví dụ về chí công vô tư
_HOOK_
Cách tính Xác Suất lượng Khi mang đến trước những độ quý hiếm lượng mol nhân tố và lượng phân tử của phù hợp chất?
Để tính Xác Suất lượng của một phù hợp hóa học lúc biết độ quý hiếm lượng mol nhân tố và lượng phân tử của phù hợp hóa học, tớ rất có thể dùng công thức sau:
Phần trăm lượng = (khối lượng mol nhân tố / lượng phân tử của phù hợp chất) x 100%
Dưới đấy là tiến độ cụ thể nhằm tính Xác Suất khối lượng:
Bước 1: Xác toan lượng mol nguyên vẹn tố
- Trước tiên, các bạn nên biết lượng mol của những nhân tố nhập phù hợp hóa học. Các độ quý hiếm này thông thường được cung ứng nhập bảng tuần trả hoặc rất có thể nhìn thấy bên trên những tư liệu thực nghiệm hoặc sách giáo trình. Hãy ghi lại những độ quý hiếm lượng mol của toàn bộ những nhân tố nhập phù hợp hóa học.
Bước 2: Tính tổng lượng mol nguyên vẹn tố
- Tiếp theo đòi, hãy tính tổng lượng mol của toàn bộ những nhân tố nhập phù hợp hóa học bằng phương pháp nằm trong lại những độ quý hiếm lượng mol của bọn chúng.
Bước 3: Xác toan lượng phân tử của phù hợp chất
- Tìm độ quý hiếm lượng phân tử của phù hợp hóa học trong những mối cung cấp tin tưởng thực nghiệm hoặc sách giáo trình. Ghi lại độ quý hiếm này.
Bước 4: Tính Xác Suất khối lượng
- Sử dụng công thức của Xác Suất lượng, phân tách lượng mol nhân tố mang đến lượng phân tử của phù hợp hóa học, tiếp sau đó nhân thành quả với 100%.
- Kết trái ngược đó là Xác Suất lượng của từng nhân tố nhập phù hợp hóa học.
Ví dụ minh họa:
Giả sử tất cả chúng ta với phù hợp hóa học NaCl (muối bột) và mong muốn tính Xác Suất lượng của Na và Cl nhập phù hợp hóa học này.
Bước 1: Xác toan lượng mol nguyên vẹn tố
- Na với lượng mol là 22,99 g/mol
- Cl với lượng mol là 35,45 g/mol
Bước 2: Tính tổng lượng mol nguyên vẹn tố
- Tổng lượng mol nhân tố = lượng mol của Na + lượng mol của Cl
= 22,99 g/mol + 35,45 g/mol = 58,44 g/mol
Bước 3: Xác toan lượng phân tử của phù hợp chất
- Khối lượng phân tử của NaCl (muối bột) là 58,44 g/mol
Bước 4: Tính Xác Suất khối lượng
- Phần trăm lượng của Na = (22,99 g/mol / 58,44 g/mol) x 100% ≈ 39,34%
- Phần trăm lượng của Cl = (35,45 g/mol / 58,44 g/mol) x 100% ≈ 60,66%
Vì vậy, Xác Suất lượng của Na nhập muối hạt bột NaCl là 39,34% và Xác Suất lượng của Cl là 60,66%.
Đây đó là phương pháp để tính Xác Suất lượng lúc biết độ quý hiếm lượng mol nhân tố và lượng phân tử của phù hợp hóa học.
Ví dụ minh họa về cách tính phần trăm khối lượng của một phù hợp chất?
Để tính Xác Suất lượng của một phù hợp hóa học, chúng ta cũng có thể dùng công thức sau:
Phần trăm lượng = (khối lượng mol nguyên vẹn tố/khối lượng phân tử của phù hợp chất) x 100.
Dưới đấy là một ví dụ minh họa về cách tính phần trăm khối lượng của một phù hợp chất:
Ví dụ: Tính Xác Suất lượng của phù hợp hóa học H2O.
Bước 1: Xác toan lượng mol của nhân tố nhập phù hợp hóa học. Trong tình huống này, phù hợp hóa học H2O bao gồm nhì nhân tố là hydro (H) và oxi (O). Khối lượng mol của nhân tố hydrogen (H) là 1 trong những,00784 g/mol và nguyên vẹn tử oxi (O) là 15,999 g/mol.
Bước 2: Tính lượng phân tử của phù hợp hóa học. Sử dụng lượng mol của từng nhân tố, tớ có:
Khối lượng phân tử của H2O = (khối lượng mol H x số nguyên vẹn tử H) + (khối lượng mol O x số nguyên vẹn tử O)
= (1,00784 x 2) + (15,999 x 1)
= 2,01568 + 15,999
= 18,01468 g/mol
Bước 3: sát dụng công thức nhằm tính Xác Suất lượng. Thay thế những độ quý hiếm nhập công thức:
Phần trăm lượng = (khối lượng mol nguyên vẹn tố/khối lượng phân tử của phù hợp chất) x 100
Phần trăm lượng = (2,01568 g/mol/18,01468 g/mol) x 100
Phần trăm lượng ≈ 11,19%
Vậy, Xác Suất lượng của nguyên vẹn tử hydro (H) nhập phù hợp hóa học H2O là khoảng chừng 11,19%.
![]()
Làm thế này nhằm triển khai tiến độ tính Xác Suất lượng một cơ hội đúng mực và xứng đáng tin tưởng cậy?
Để tính Xác Suất lượng một cơ hội đúng mực và uy tín, chúng ta cũng có thể triển khai công việc sau đây:
Bước 1: Xác toan lượng của hóa học cần thiết tính Xác Suất lượng. Đây là lượng của hóa học tuy nhiên mình thích biết Xác Suất nhập láo lếu phù hợp.
Bước 2: Tính tổng lượng của toàn cỗ láo lếu phù hợp. Đây là lượng của toàn cỗ láo lếu phù hợp chứa chấp hóa học cần thiết tính Xác Suất lượng.
Bước 3: Sử dụng công thức Xác Suất khối lượng: Xác Suất lượng = (khối lượng của chất/khối lượng của toàn cỗ láo lếu hợp) x 100%.
Bước 4: sát dụng công thức bên trên nhằm đo lường và tính toán Xác Suất lượng của hóa học cần thiết tính.
Ví dụ:
Giả sử mình thích tính Xác Suất lượng của một nhân tố nhập một phù hợp hóa học với lượng mol nhân tố là 20g và lượng phân tử của phù hợp hóa học là 100g.
Bước 1: Xác toan lượng của hóa học cần thiết tính Xác Suất lượng. Trong tình huống này, lượng của hóa học cần thiết tính là 20g.
Bước 2: Tính tổng lượng của toàn cỗ láo lếu phù hợp. Trong tình huống này, tổng lượng của toàn cỗ láo lếu phù hợp là 100g.
Bước 3: sát dụng công thức Xác Suất khối lượng: Xác Suất lượng = (khối lượng của chất/khối lượng của toàn cỗ láo lếu hợp) x 100%. Trong tình huống này, Xác Suất lượng của nhân tố là (20g/100g) x 100% = 20%.
Điều cần thiết Khi triển khai tiến độ tính Xác Suất lượng là đáp ứng xác lập đúng mực lượng của từng bộ phận và toàn cỗ láo lếu phù hợp. Bên cạnh đó, việc dùng công thức Xác Suất lượng được tế bào mô tả phía trên là 1 cơ hội uy tín nhằm đo lường và tính toán Xác Suất lượng.
Ứng dụng công thức tính Xác Suất lượng nhập nghành nghề nào?
Công thức tính Xác Suất lượng được vận dụng trong vô số nghành nghề không giống nhau, bao hàm chất hóa học, sinh học tập, nó học tập, và nghệ thuật. Dưới đấy là một số trong những ví dụ về phần mềm công thức tính Xác Suất khối lượng:
1. Hóa học: Công thức này hùn xác lập tỷ trọng Xác Suất lượng của những nhân tố nhập một phù hợp hóa học. Vấn đề này vô cùng cần thiết trong các việc phân tích và phát triển những phù hợp Hóa chất.
2. Sinh học: Trong sinh học tập, công thức này rất có thể được dùng nhằm tính Xác Suất lượng của những hóa học tồn bên trên nhập một kiểu hoặc một khối hệ thống. Ví dụ, Xác Suất lượng của những protein nhập một tế bào rất có thể được xem toán nhằm hiểu về sự việc phân bổ hóa học nhập tế bào.
3. Y học: Công thức tính Xác Suất lượng cũng rất có thể được dùng nhập nó học tập nhằm xác lập hiệu suất cao của một phác hoạ đồ gia dụng chữa trị. Ví dụ, Xác Suất lượng của một loại thuốc chữa bệnh nhập một dạng dược phẩm rất có thể hùn Review hiệu suất cao và bạt mạng lượng thích hợp của dung dịch cơ.
4. Kỹ thuật: Trong những ngành nghệ thuật, công thức này rất có thể được dùng nhằm đo lường và tính toán Xác Suất lượng của những bộ phận nhập một láo lếu phù hợp vật tư. Ví dụ, nhập ngành thiết kế, Xác Suất lượng của những bộ phận nhập bê tông rất có thể được xem toán nhằm đáp ứng unique của thành phầm sau cuối.
Như vậy, công thức tính Xác Suất lượng với thật nhiều phần mềm trong những nghành nghề không giống nhau. Việc hiểu và vận dụng công thức này sẽ hỗ trợ tất cả chúng ta với ánh nhìn rõ ràng rộng lớn về bộ phận và tỷ trọng của những hóa học nhập một khối hệ thống này cơ.
Xem thêm: nhất chí hay nhất trí
Có những nguyên tố này tác động cho tới thành quả tính Xác Suất lượng và thực hiện thay cho thay đổi thành quả dự tính?
Có một số trong những nguyên tố rất có thể tác động cho tới thành quả tính Xác Suất lượng và thực hiện thay cho thay đổi thành quả dự trù. Dưới đấy là những nguyên tố quan tiền trọng:
1. Độ đúng mực của lượng chất: Kết trái ngược tính Xác Suất lượng tiếp tục tùy theo chừng đúng mực của lượng hóa học được dùng nhập luật lệ đo. Để với thành quả đúng mực, cần dùng những tranh bị cân nặng đáp ứng được cho phép đo đúng mực và cân nặng được hiệu chỉnh đúng chuẩn.
2. Độ đúng mực của lượng láo lếu hợp: Nếu đang được tính Xác Suất lượng của một láo lếu phù hợp, nguyên tố này càng cần thiết. Kết trái ngược đo lường và tính toán rất có thể bị sai chênh chếch nếu như lượng của láo lếu phù hợp ko được xác lập đúng mực.
3. Độ đúng mực của lượng phân tử: Để tính Xác Suất lượng, nên biết lượng phân tử của hóa học cần thiết tính. Nếu độ quý hiếm này sẽ không đúng mực, thành quả đo lường và tính toán tiếp tục sai chênh chếch.
4. Độ đúng mực của lượng mol nguyên vẹn tố: Khi tính Xác Suất lượng, nên biết lượng mol của nhân tố với nhập hóa học. Nếu độ quý hiếm này sẽ không đúng mực, thành quả đo lường và tính toán cũng sẽ ảnh hưởng sai chênh chếch.
5. Sự hiện hữu của hóa học tạp: Nếu nhập kiểu với những hóa học tạp không giống, bọn chúng rất có thể tác động cho tới thành quả tính Xác Suất lượng của hóa học cần thiết tính. Vì vậy, rất cần được vô hiệu hoặc xác lập đúng mực lượng của những hóa học tạp này để sở hữu thành quả đúng mực.
6. Độ đúng mực của quy trình đo và tính toán: Kết trái ngược tính Xác Suất lượng cũng tùy theo chừng đúng mực của quy trình đo và đo lường và tính toán. Việc thực hiện sai nhập công việc đo lường và tính toán rất có thể dẫn theo thành quả ko đúng mực.
Để với thành quả đo lường và tính toán đúng mực, rất cần được đáp ứng đúng mực của những nguyên tố bên trên và vâng lệnh tiến độ đo lường và tính toán đúng chuẩn.
_HOOK_











Bình luận